AB-16B5 (anti-clustérine sécrétée)
L’AB-16B5 pour l’inhibition de la transition épithélio-mésenchymateuse (TEM)
Alethia travaille à la mise au point d’un inhibiteur de la TEM pour le traitement des carcinomes invasifs. L’AB-16B5 est un anticorps humanisé de type IgG2 dirigé contre une forme sécrétée de clustérine (sCLU) inductrice de la TEM. L’AB-16B5 inhibe très efficacement la TEM, et les données précliniques indiquent que les animaux ayant reçu une xénogreffe de diverses cellules de carcinome présentent une augmentation de la réponse aux chimiothérapies de référence, ainsi qu’une diminution de l’invasion.
Contexte et justification
Les mécanismes moléculaires responsables de l’apparition d’un cancer métastatique commencent à être mieux compris grâce à l’identification de facteurs de régulation clés. De plus en plus de données portent à croire que la transition épithélio-mésenchymateuse (TEM) des cellules tumorales jouerait un rôle important dans l’évolution métastatique. La survenue d’une TEM durant la progression tumorale permet aux cellules épithéliales de la tumeur, qui ne sont pas invasives ni métastatiques, de s’éloigner de la tumeur primitive, d’envahir les tissus environnants, d’entrer dans la circulation sanguine et, enfin, de se disséminer vers d’autres foyers pour y proliférer. De plus, les cellules cancéreuses épithéliales qui subissent une TEM adoptent un comportement très semblable à celui des cellules souches cancéreuses (CSC), notamment une résistance intrinsèque à la chimiothérapie et à la radiothérapie. Ainsi, la découverte de protéines qui participent directement à la TEM et la stimule pourrait produire de nouvelles cibles permettant d’augmenter la sensibilité des tumeurs à la chimiothérapie et de prévenir la dissémination des cellules de la tumeur primitive vers d’autres sites.
La clustérine est un facteur crucial de la stimulation de la TEM.
On a observé qu’une protéine sécrétée appelée clustérine (sCLU) était stimulée pendant la TEM et pouvait, d’elle-même, favoriser le processus de TEM. Ainsi, les cellules cancéreuses épithéliales exposées à la sCLU adoptent une morphologie mésenchymateuse, présentent une mobilité accrue et cessent d’exprimer des molécules d’adhésion cellulaire épithéliales telles que l’E-cadhérine. Fait important, la surexpression de la sCLU est observée dans plusieurs cancers, dont les cancers de la prostate, de la vessie, du rein, du sein, du côlon et du poumon. De plus, le degré d’expression de la sCLU associée à la tumeur augmente parallèlement à la progression de la maladie et cette expression tumorale contribue à la prolifération et à la survie des cellules cancéreuses. Par conséquent, le rôle de la sCLU dans les affections malignes de même que nos observations originales sur son rôle de puissant déclencheur de la TEM suggèrent que l’inhibition de l’activité de la sCLU représente une stratégie pour réduire ou prévenir l’invasion tumorale et augmenter la sensibilité à la chimiothérapie.
L’AB-16B5, un nouvel inhibiteur de la TEM
La sCLU a un domaine qui lui confère son activité inductrice de la TEM et nous avons identifié des anticorps qui interagissent spécifiquement avec ce domaine et inhibent son activité. Le principal anticorps dans ce programme est appelé AB-16B5; il s’agit d’une IgG2 humanisée qui inhibe la TEM dans les cellules cancéreuses in vitro et prévient l’invasion tumorale in vivo dans des modèles animaux de métastases. Des études de xénogreffes de cancers de la prostate et du pancréas humains chez des animaux ont montré que l’inhibition de l’activité de la sCLU associée à la tumeur entraîne une réponse accrue aux agents chimiothérapeutiques standards tels que le docetaxel et la gemcitabine, comme en atteste une réduction significative de la croissance tumorale. Fait à souligner, le traitement par l’AB-16B5 seul a réduit la croissance tumorale et a augmenté la survie chez les animaux traités. Ces observations et les résultats de plusieurs autres études in vivo ont montré que l’inhibition de la sCLU associée à la tumeur au moyen de l’AB-16B5 augmentait la réponse à la chimiothérapie et réduisait l’invasion et la croissance tumorales.
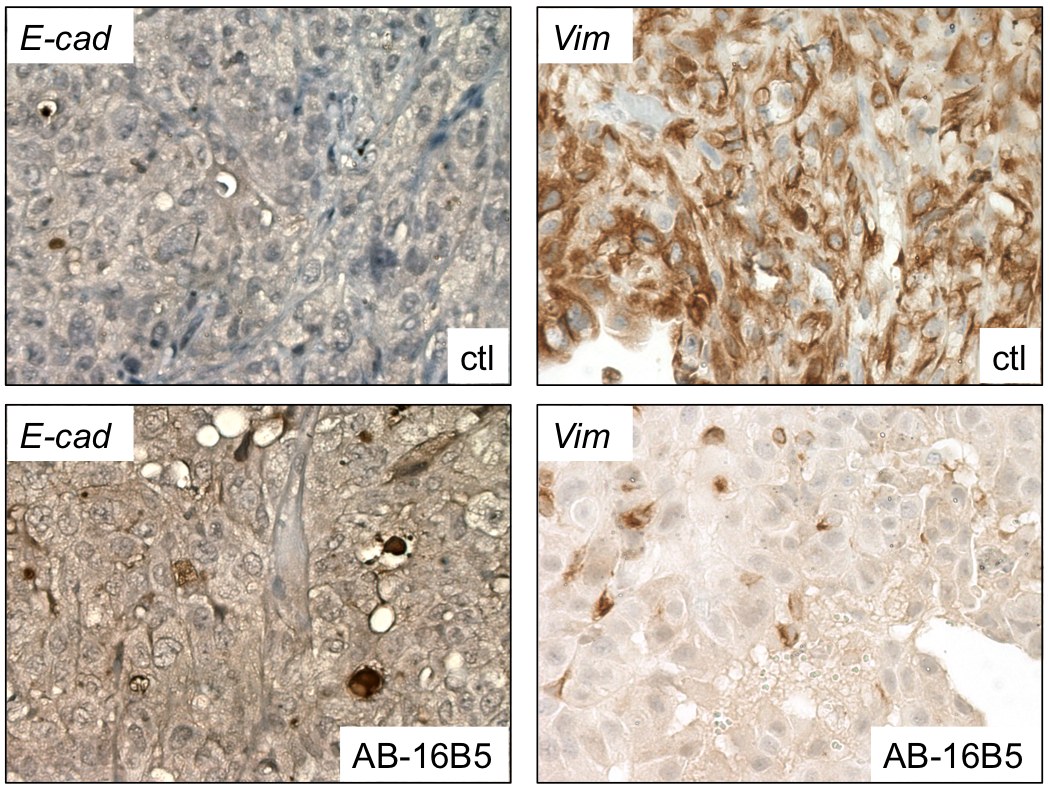
En accord avec ces données sur l’efficacité, l’analyse par immunohistochimie de xénogreffes de tumeur de la prostate provenant de souris traitées par l’AB-16B5 a révélé une hausse de l’expression de l’E-cadhérine, un marqueur des cellules épithéliales, et une baisse de l’expression de la vimentine, un marqueur des cellules mésenchymateuses (voir ci-dessous). Des résultats semblables ont été observés dans des tumeurs pancréatiques et pulmonaires traitées par l’AB-16B5.
L’examen de l’expression de CD44 dans ces tumeurs a révélé que l’AB-16B5 provoquait une diminution très marquée de cette protéine. On sait que la protéine CD44 est associée à la présence de cellules souches tumorales (CSC); cette observation appuie donc l’hypothèse d’un lien direct entre la TEM et la formation de CSC dans les tumeurs. En fait, bien qu’on ignore si l’inhibition de la sCLU avec l’AB-16B5 a un effet direct sur le renouvellement des CSC, ce résultat laisse penser que l’activité de l’AB-16B5 réduirait le nombre de CSC dans les tumeurs.
L’AB-16B5 a également été évalué in vivo dans le cancer du poumon où il s’est révélé d’une efficacité semblable en association avec le docetaxel. En parallèle, nous avons établi que la sCLU influençait directement l’expression et l’activation de l’EGFR (récepteur du facteur de croissance épidermique). En bref, nous avons découvert que l’incubation de lignées cellulaires de CPNPC avec l’AB-16B5 maintenait un degré élevé d’expression de l’E-cadhérine en plus de provoquer une augmentation des taux d’EGFR et de sa phosphorylation. Ces observations impliquent que ces cellules cancéreuses pourraient présenter une réponse accrue aux inhibiteurs de l’EGFR, y compris aux inhibiteurs de tyrosine kinase et aux anticorps monoclonaux contre l’EGFR.
Ensemble, ces résultats excitants confirment le bien-fondé de la stratégie thérapeutique consistant à cibler la sCLU pour inhiber la TEM. En fait, l’AB-16B5 représente l’un des rares inhibiteurs de la TEM à avoir produit cet effet inhibiteur in vivo dans des modèles humains de cancer.